چگونه یک درمان ژنی، هانتینگتون را ممکن است به زانو درآورده باشدآیا رویای مهار هانتیگتون به واقعیت رسیده است؟
چگونه یک درمان ژنی، هانتینگتون را ممکن است به زانو درآورده باشد
تصور کنید بیماریای که آرام و بیصدا، مغز را از درون فرسوده میکند: نخست با اختلال در حرکت، بعد با مشکلات حافظه و در نهایت با گرفتن توانایی انجام کارهای سادهٔ روزمره. این همان هانتینگتون است؛ یک اختلال ژنتیکی نادر اما ویرانگر که تاکنون هیچ درمانی برای متوقف کردنش وجود نداشته است.
اکنون اما خبر تازهای منتشر شده که میتواند آغاز فصلی جدید و روزنه امیدی برای مبتلایان باشد. پژوهشگران شرکت هلندی uniQure همراه با تیمی از دانشگاه کالج لندن (UCL) اعلام کردهاند که ژندرمانی تازهای به نام AMT-130 توانسته سرعت پیشرفت بیماری را در بیماران دریافتکنندهٔ دوز بالا تا ۷۵ درصد طی سه سال کاهش دهد.
این دستاورد هنوز در مراحل نخستین آزمایش است و پرسشهای زیادی بیپاسخ مانده، اما برای جامعهای که سالها تنها بر مدیریت علائم و نشانگان تکیه کرده بود، این یافته نشانهای روشن است: شاید بتوان به جای تسلیم شدن در برابر روند اجتنابناپذیر بیماری، مسیر آن را تغییر داد.
داستان هانتینگتون: از یک ژن معیوب تا ویرانی تدریجی مغز
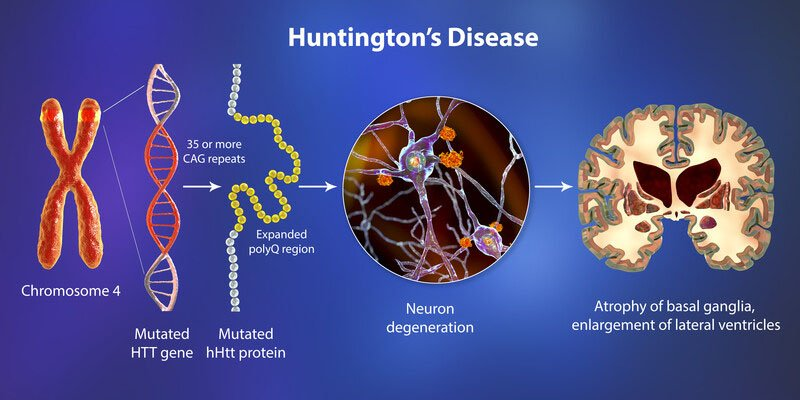
هانتینگتون، یک بیماری نورودژنراتیو ارثی، مانند یک بمب ساعتی ژنتیکی عمل میکند که از والدین به فرزندان منتقل میشود — با الگویی اتوزومال غالب، یعنی حتی یک کپی معیوب از ژن کافی است تا بیماری ظاهر شود. این اختلال ریشه در ژن HTT روی کروموزوم ۴ دارد، جایی که توالی تکراری CAG (که کد گلوتامین را میسازد) بیش از حد گسترش مییابد. در افراد سالم، این تکرارها معمولاً بین ۱۰ تا ۳۵ بار است، اما در بیماران هانتینگتون، بیش از ۴۰ تکرار (و گاهی تا صدها بار) دیده میشود — این گسترش مانند یک خطای کپیبرداری در DNA است که با هر نسل میتواند طولانیتر شود، پدیدهای به نام “پیشبینی” (anticipation) که باعث شروع زودهنگامتر بیماری در فرزندان میشود.
اما ژن HTT چطور رفتار میکند؟ در حالت عادی، پروتئین هانتینگتین نقشهای حیاتی در سلولهای عصبی ایفا میکند، از جمله حملونقل مواد داخل سلولی، تنظیم بیان ژنها و حفاظت از نورونها. اما وقتی تکرارهای CAG بیش از حد شوند، پروتئین هانتینگتین جهشیافته (mHTT) با یک زنجیره طولانی پلیگلوتامین تولید میشود. این زنجیره باعث میشود پروتئین بدشکل شود، به هم بچسبد و تجمعات سمی (aggregates) تشکیل دهد — مثل تودههای زباله که سلول را مسدود میکنند. این تجمعات نه تنها عملکرد طبیعی سلول را مختل میکنند، بلکه مکانیسمهای سلولی را به هم میریزند: اختلال در رونویسی DNA (که بیان ژنها را کنترل میکند)، آسیب به میتوکندریها (نیروگاههای انرژی سلول)، افزایش حساسیت به گلوتامات (excitotoxicity) که نورونها را بیش از حد تحریک و نابود میکند، و ضعف در سیستم پاکسازی پروتئینهای آسیبدیده (مانند اوتوفاژی و یوبیکوئیتین-پروتئازوم). نتیجه؟ یک زنجیره ویرانگر که از اختلال عملکرد سیناپسها (ارتباط بین نورونها) شروع میشود و به مرگ تدریجی سلولهای عصبی ختم میگردد.

تأثیر بر مغز چطور پیش میرود؟ این فرآیند عمدتاً striatum (شامل هسته کادات و پوتامن) را هدف میگیرد — نواحی کلیدی در عقدههای قاعدهای که حرکت، تصمیمگیری و کنترل هیجانی را مدیریت میکنند. ابتدا، نورونهای متوسط خاردار (medium spiny neurons) — که ۹۵ درصد striatum را تشکیل میدهند — آسیب میبینند، منجر به کاهش GABA (مهارکننده عصبی) و اختلال در مدارهای حرکتی میشود. این باعث علائم حرکتی اولیه مانند کره (حرکات ناخواسته و رقصمانند دستها و پاها) میگردد. با پیشرفت، آسیب به کورتکس (لایه بیرونی مغز) گسترش مییابد، که مسئولیت cognition و رفتار را بر عهده دارد، و علائم شناختی مانند کندی فکر، مشکلات حافظه و تغییرات خلقی (از افسردگی تا پرخاشگری) ظاهر میشود. در مراحل پیشرفته، هیپوکامپوس و سایر نواحی درگیر میشوند، منجر به دیسآرتری (مشکل در تکلم)، مشکلات بلع، و ناتوانی کامل در حرکت و مراقبت از خود. علائم معمولاً در سنین ۳۰ تا ۵۰ سالگی شروع میشوند، اما موارد نوجوانی (با تکرارهای بیشتر) هم وجود دارد. بدون درمانهای تغییردهنده مسیر بیماری، بیماران طی ۱۰ تا ۲۰ سال پس از شروع علائم، به دلیل عفونتها، سقوط یا ناتوانی تنفسی، جان خود را از دست میدهند.
شیوع این بیماری چقدر است؟
در جمعیتهای غربی و اروپاییتبار، حدود ۵ تا ۱۴ نفر در هر ۱۰۰ هزار نفر — که بالاترین نرخ در اروپا و آمریکای شمالی ثبت شده است. در ایران و خاورمیانه، آمار دقیقتر نیاز است، اما موارد گزارششده نشان میدهد شیوع کم نیست، بهویژه در جوامع با ریشههای مهاجرتی اروپایی، هرچند پایینتر از غرب تخمین زده میشود.
تا کنون، درمانهای موجود سعی می کردند نشانگان یا عوارض این بیماری را مها کنند تا بتوانند بر کیفیت زندگی مبتلایان اضافه کنند.
داروهایی مانند تترابنازین برای کاهش حرکات ناخواسته، ضدافسردگیها برای مشکلات روانی، فیزیوتراپی برای حفظ حرکت، و حمایتهای خانوادگی و روانشناختی برای مقابله با بار عاطفی.
اما چرا هانتینگتون اینقدر اهمیت دارد؟ چون نه تنها فرد را نابود میکند، بلکه خانوادهها را درگیر یک چرخه اضطراب ژنتیکی میسازد — تستهای پیشبینیکننده میتوانند آینده را تاریک کنند، و نبود درمان واقعی، حس درماندگی عمیقی ایجاد میکند. حالا، با ورود AMT-130، این داستان ممکن است تغییر کند: ” شاید دری به سوی مهار واقعی بیماری باز شده باشد.”
AMT-130 چطور کار میکند؟ یک ویروس هوشمند در نقش نجاتدهنده
تصور کنید یک ویروس بیخطر — از نوع AAV5 (آدنوویروس وابسته) — که به عنوان یک حامل ژنتیکی عمل میکند، و همانند یک پستچی دقیق که بستهای ویژه را مستقیماً به مقصد میرساند یک قطعه ژنتیکی را مستقیما به سلولهای هدف فرد بیمار میرساند.
شرکت uniQure این ویروس را مهندسی کرده تا حاوی یک قطعه ژنتیکی به نام میکروRNA (miHTT) باشد — یک مولکول کوچک RNA که مانند یک قیچی مولکولی، مستقیماً به mRNA ژن HTT میچسبد و جلوی ترجمه آن به پروتئین را میگیرد. فرآیند دقیقتر این است: miHTT با اتصال به mRNA، آن را برای تخریب توسط مکانیسمهای سلولی (مانند کمپلکس RISC) علامتگذاری میکند، که منجر به کاهش سطح پروتئین هانتینگتین میشود. این کاهش نه تنها نسخه جهشیافته (mHTT) با زنجیره طولانی پلیگلوتامین را هدف میگیرد، بلکه بخشی از پروتئین طبیعی HTT را هم کم میکند — استراتژیای که هدفش سبک کردن بار سمی کلی در نورونهاست، حتی اگر این روند به طور کامل رخ ندهد.
مطالعات پیشبالینی نشان داده که این کاهش تا ۵۰-۸۰ درصد میتواند بدون آسیب جدی به عملکرد طبیعی سلولها باشد، اما در انسان، این تعادل هنوز تحت بررسی است. به عبارت دیگر ما هنوز باید بدانیم کاهش میزان طبیعی HTT تا چه حدی ممکن است بدون بروز عوارض جانبی برای فرد – ناشی از عملکرد طبیعی این عامل – قابل اعمال باشد.
اما چطور این درمان به مغز میرسد؟
هانتیگتون در مغز عمل میکند و این چالش دیگری برای حمله کردن به آن است. مغز ما ساختار دفاعی منحصر به فرد خود را دارد که گذر از آن به این سادگی نیست.
مغز توسط سد خونی-مغزی محافظت میشود — یک لایه سلولی نفوذناپذیر که داروهای معمولی را بیرون نگه میدارد. برای غلبه بر این سد، پزشکان باید مستقیما به پشت آن نفوذ کرده و دارو را به مقصد برسانند و برای این کار از روش جراحی استریوتاکتیک استفاده میکنند: یک عمل دقیق با هدایت تصویربرداری (مثل MRI، که مانند GPS سهبعدی مغز عمل میکند)، جایی که ویروس مستقیماً به نواحی آسیبدیده — یعنی عقدههای قاعدهای (basal ganglia)، شامل هسته کادات و پوتامن — تزریق میشود.
این تزریق از طریق سوراخهای کوچک در جمجمه انجام میگیرد، و ویروس AAV5 به دلیل تواناییاش در عفونت پایدار نورونها (بدون ادغام در DNA میزبان، که ریسک سرطان را کم میکند)، بیان miHTT را برای سالها حفظ میکند. اما این این روشی تهاجمی است؟ بله، عمل چندساعته است و نیاز به بیهوشی و تیم جراحی متخصص دارد و طبیعتا خطرات ناشی از عمل جراحی را به همراه دارد اما مزیتش یکبارگی است به عبارت دیگر درمان با یک بار عمل انجام میشود و نیاز به تکرار دائم این روند نیست.
در کارآزمایی فاز ۱/۲ که توسط uniQure و UCL رهبری شد، ۲۹ بیمار شرکت کردند: ۱۷ نفر دوز بالا دریافت کردند و ۱۲ نفر دوز پایین.
نتایج، طبق اعلام ۲۴ سپتامبر ۲۰۲۵، چشمگیر بود: در گروه دوز بالا، امتیاز معیار مرکب عملکرد هانتینگتون (cUHDRS — که ترکیبی از ارزیابیهای حرکتی مانند تستهای تعادل و سرعت، شناختی مانند آزمونهای حافظه و تمرکز، و عملکردی مانند توانایی کارهای روزانه است) طی سه سال تنها ۰٫۳۸ واحد کاهش یافت. در مقابل، گروه کنترل تطبیقی (بر اساس دادههای تاریخی از بیماران مشابه بدون درمان) ۱٫۵۲ واحد افت داشت — یعنی پیشرفت بیماری ۷۵ درصد کندتر شد، و این تفاوت از نظر آماری معنادار بود. علاوه بر این، سطح نوروفیلامنت سبک (NfL) — یک پروتئین که هنگام آسیب نورونها به مایع نخاعی نشت میکند و نشانگر زیستی پیشرفت بیماری است — در گروه درمان کاهش یافت، که با بهبود بالینی همخوانی دارد و نشان میدهد درمان واقعاً مسیر آسیب را آهسته کرده، نه فقط علائم را پوشانده.
چرا این خبر جهان را تکان داد؟
اول، امید ملموس برای یک بیماری لاعلاج: تلاش برای درمان هانتینگتون دهههاست که در مدلهای حیوانی (مثل موشهای تراریخته با ژن HTT جهشیافته) با درمانهای کاهنده HTT امیدوارکننده بوده است، اما این اولین بار است که در انسان، یک درمان ژنی نشان از موفقیت در “تغییر مسیر بیماری” (disease-modifying) دارد — یعنی نه فقط تسکین موقت علائم با داروهای مهار کننده عوارض، بلکه حمله به ریشه ژنتیکی بیماری. uniQure اعلام کرده اگر دادهها در پیگیریها پایدار بماند، سال ۲۰۲۶ برای مجوزهای نظارتی مانند BLA (درخواست مجوز بیولوژیک) از FDA اقدام میکند. تصور کنید: برای میلیونها حامل ژن HTT (که حدود ۳۰-۴۰ هزار بیمار فعال در جهان هستند)، یک تست ژنتیکی زودهنگام و یک تزریق واحد میتواند شروع علائم را عقب بیندازد و دههها زندگی باکیفیت اضافه کند.
دوم، درس بزرگ برای علم نورولوژی: این پروژه، همکاری بین دانشگاه کالج لندن (UCL) با رهبرانی مانند پروفسور سارا تبریزی (متخصص نورودژنراسیون) و دکتر اد وایلد (پژوهشگر نشانگرهای زیستی)، و شرکت uniQure، نمونهای کلاسیک از ترجمه علم پایه به کاربرد بالینی است. در گزارش STAT News، مدیر ارشد پزشکی uniQure آن را “زمینهساز آینده” نامید، چون موفقیت AMT-130 میتواند الگویی برای درمانهای ژنی در بیماریهای مشابه مانند آلزایمر (با تجمع بتا-آمیلوئید) یا پارکینسون (با آلفا-سینوکلئین) باشد — جایی که کاهش پروتئینهای سمی کلیدی است.

سوم، اهمیت شخصی برای شما: اگر در خانوادهتان سابقه هانتینگتون دارید، یا حتی اگر فقط به پیشرفتهای پزشکی علاقهمندید، این خبر مهمی است: ژنتیک دیگر سرنوشت مطلق نیست. در ایران و خاورمیانه، جایی که دسترسی به فناوریهای پیشرفته مانند جراحی استریوتاکتیک محدود است و هزینهها بالاست، این پیشرفت میتواند بحث عدالت سلامت را داغ کند — چطور درمانهایی مثل این – در صورت تایید و عملیاتی شدن می توانند به کشورهای در حال توسعه برسد؟ سازمانهایی مانند WHO ممکن است در آینده مدلهای دسترسی جهانی پیشنهاد کنند، اما فعلاً، این یادآوری است که علم مرز نمیشناسد اگرچه برخورداری از مواهب این پیشرفت شاید نیازمند بازنگری در مدلهای اقتصاد پزشکی وس لامت باشد.
نقاط ضعف این پژوهش
این نتایج هیجانانگیزند، اما علم همیشه با احتیاط پیش میرود. اندازه نمونه کوچک (فقط ۲۹ نفر) و نبود گروه کنترل همزمان و تصادفی (به جای آن، از دادههای خارجی و تاریخی استفاده شد) یعنی نتایج مقدماتیاند — ممکن است عوامل خارجی مانند تفاوتهای سنی یا سبک زندگی تأثیر گذاشته باشند، و نیاز به کارآزماییهای فاز ۳ بزرگتر (با صدها بیمار) و کنترلشده وجود دارد. علاوه بر این، AMT-130 اختصاصی نیست و HTT طبیعی را هم کاهش میدهد؛ مطالعات حیوانی نشاندهنده ایمنی این روش و کاهش میزان طبیعی HTT است، اما عوارض بلندمدت در انسان — مانند اختلال در حملونقل سلولی یا ضعف نورونها — هنوز نامشخص است و نیاز به پیگیریهای ۱۰-۱۵ ساله دارد.
جراحی هم چالشبرانگیز است: نیاز به تجهیزات پیشرفته MRI، تیمهای جراحی نورولوژیک متخصص، و هزینهای که میتواند به میلیونها دلار برسد (هرچند بیمهها ممکن است پوشش دهند). موضوع دیگر که باید بیشتر بررسی شود مصاله ایمنی AAV5 است. ویروسها میتوانند واکنش ایمنی (مانند التهاب) ایجاد کنند یا به ندرت در DNA ادغام شوند، که ریسک تغییرات ژنومی دارد — لذا رصد ۵-۱۰ ساله ضروری است. اگر بیان miHTT پس از سالها کم شود، آیا تکرار تزریق ایمن است؟ این سؤال هنوز بیپاسخ است.
در مقاله Science، کارشناسان تأکید کردند: “این یک گام عظیم است، اما نه پایان ماجرا.” دوام اثر فراتر از سه سال، تأثیر در زیرگروههای مختلف(مانند بیماران جوان یا با تکرارهای CAG بیشتر)، و مقایسه با روشای رقیب رقبا مانند آنتیسنس الیگونوکلئوتیدها (ASOها، که تزریقی ماهیانهاند اما کمتر تهاجمی) یا استفاده از روشهای دقیق ویرایش ژنی مانند کریسپر (که میتواند تکرارهای CAG را دقیق برش دهد اما ریسک برشهای ناخواسته دارد) هنوز مبهم است.
قدمهای بعدی چیست؟
ابتدا، محققان باید داده های تحقیق خود و روند آن را در ژورنالهای دارای بازبینی همرده و معتبر منتشر کنند تا دانشمندان مستقل بتوانند تحلیلهای حساسیت، واریانسها و زیرگروهها را بررسی کنند و به بررسی و مرورو روند تحقیق انجام شده بپردازند.
سپس، کارآزماییهای بزرگتر و چندمرکزی با کنترل همزمان، معیارهای سختگیرانهتر (مانند بقا یا کیفیت زندگی)، و جمعیتهای متنوع (شامل غیراروپاییها). پیگیری طولانیمدت برای ایمنی و دوام باید ترتیب داده شود. در این مورد شرکت — uniQure قول داده برنامههای ۱۵ ساله ای در این زمینه را دنبال کند اما اهمیت این درمان نیاز به کارآزمایی های دقیق و طولانی را ضروری میکند.
ما هنوز مطئن نیستیم روش نهایی مقابله با هانتیگتون چه خواهد بود شاید این روش تازه به انقلابی بی نظیر بدل شود و یا شاید به یکی از ابزارهای ما در جعبه ابزار مقابله با این بمیاری تبدیل شود که می تواند د رکنار روش های دیگر طول عمر و کیفیت زندگی مبتلایان را بهبود بخشد
uniQure و UCL متعهد شدهاند تلاش خود را برای دسترسی عادلانه همگان به این فناوری در صورت تایید کارآمدی به کار برند که شامل مواردی مانند استانداردسازی جراحی، آموزش جراحان در کشورهای مختلف و مدلهای پرداخت مبتنی بر نتیجه (مانند بازپرداخت هزینهها در صورت عدم موفقیت درمان)
در نهایت، AMT-130 مانند یک شمع در تاریکی هانتینگتون است — نه خورشید کامل، اما نور کافی برای دیدن راه پیش رو را مقابل چشمان ما می گذارد.
ربرای بیماران و خانوادههایی که سالها در انتظار بودند، این خبر میگوید: مبارزه ادامه دارد، اما حالا ابزارهای قدرتمندتری داریم. اگر ژنتیک سرنوشت را دیکته میکند، علم در حال بازنویسی آن است. و این، برای همه ما — از تهران تا لندن — نوید دنیایی را میدهد که انسان قدرت و توان مقابله با روندهای بینااری را در ریشهای ترین سطوح خود دارد.





